|
|
FUNDAMENTOS
|
Dr.
Calderón Laboratorios Ltda.
Avda 13 No. 87-81 Tel/Fax 6222687, 6224985, 6225567, 2578443 Apartado Aéreo 24888 Bogotá, D.C., Colombia - South America www.drcalderonlabs.com E-Mail acaldero@cable.net.co |
DETERMINACION DE LA DEMANDA BIOQUIMICA DE OXIGENO DBO5 METODO RESPIROMETRICO
Por: Felipe Calderón Sáenz y Margarita Pavlova.
Bogotá, Enero 15 de 2001; Rev. Enero31/2001;
Rev. Septiembre 22 de 2004; Oct 21 de 2005; Mayo 9 de 2007
Dr. Calderón Laboratorios.
www.drcalderonlabs.com
INTRODUCCION
Los siguientes métodos aunque son válidos en cualquier tiempo y lugar se hacen en la ciudad de Bogotá Colombia, ubicada a 2540 metros sobre el nivel del Mar y una Presión barométrica de 560 mm Hg. Estas condiciones afectan la disponibilidad de oxígeno disuelto disuelto en el agua y por consiguiente las condiciones en las cuales se realiza la prueba de la Demanda Bioquímica de Oxígeno en 5 días DBO5.
ANTECEDENTES
Desde principios de los años de 1900s se han utilizado varios metodos para determinar el índice de respiración de bacterias para evaluar la capacidad de una población bacteriana de quitar sustancias de las aguas residuales (tratabilidad, o biodegradabilidad) y para determinar el efecto de las sustancias en las bacterias (inhibición o toxicidad).
La tentativa más antigua para utilizar la absorción directa para medir la demanda del oxígeno de las aguas residuales fue hecha por Adney en 1890. El desarrolló un tipo de aparato manométrico de presión constante en el cual él observaba el índice de la absorción del oxígeno por el agua contaminada. A una presión constante, la disminución del volumen, debido a la absorción del oxígeno fue observada por la distancia que una columna del agua sube un un tubo vertical, graduado, en forma de "u" que conectaba dos recipientes, uno llenado parcialmente de la muestra, y el otro que contenía un volumen igual de agua. El aparato entero fue colocado a una temperatura constante en un baño de agua, y agitado periódicamente para mantener un exceso del oxígeno disuelto en la muestra. Aunque Adney encontró que este método era exacto, él concluyó que no era conveniente para el trabajo rutinario.
Rideal y Burgess (1909) utilizaron el aparato, pero lo encontraron insatisfactorio debido a los escapes que se producían en el curso de la agitación. Sugirieron que el método de la dilución, con la incubación de las botellas cerradas con la medida del oxígeno disuelto tanto antes como después de la incubación por un método modificado de Winkler era más exacto. Este método fue el precursor de la prueba estándar BOD5. Sierp (1928) y otros revivieron y modificaron el aparato de aireación directa de Adney "para reducir el dispendioso trabajo del método de la dilución y para producir lecturas rápidas, directas y frecuentes".
El respirometro de Warburg (1926) usado extensivamente por Don Bloodgood en la universidad de Purdue y por H. Huekelekian en la universidad de Rutgers fué una modificación del " manómetro de sangre-gas" desarrollado por Haldane y Barcroft (1902). El trabajo pionero de Sawyer, de Nichols y de Rohlich (1939) en el estudio y el desarrollo de las curvas de la utilización del oxígeno en lodos activados, fue hecho usando los dispositivos manométricos que ellos desarrollaron para satisfacer su necesidad de utilizar muestras más grandes y de sistemas mas herméticos - Estos sistemas, sin embargo, requerían la adición manual de aire atmosférico para suplir el oxígeno. Analistas expertos eran necesarios para funcionar y vigilar visualmente las lecturas del manómetro. La interpretación era aburrida y dispendiosa ya que no existian aparatos automatizados para la manipulación de los datos.
John W. Clark en la universidad de estado de nuevo Méjico a fines de los años 50 desarrolló y reportó un dispositivo en el cual el oxígeno fue generado por una pila electrolítica, que también funcionó como un manómetro, asociado a un reactor cerrado. Cuando el dispositivo es accionado por la reducción de la presión en el recipiente de la prueba causado por el retiro químico del CO2 generado por la respiración bacteriana, el oxígeno fue producido por una corriente controlada de corriente continua. El valor integrado de la corriente proporcionó una indicación del oxígeno consumido. Una de las primeras aplicaciones de aparato Voith-Sapromat (desarrollado por Popel en 1964) fue un procedimiento manual para evaluar el efecto de varios deshechos en degradación de la peptona. Liebmann y Offhaus también colaboraron en procedimientos para determinar la DBO5 y la toxicidad de algunos elementos en el agua.
|
|
FUNDAMENTOS
El Método Respirométrico, para la determinación de la DBO5 se basa en medir el consumo de oxígeno, o la producción de CO2, en una Botella Respirométrica. Este objetivo se logra entre otras formas (Método Manométrico) midiendo la variación de la presión en la botella, mediante un manómetro lo suficientemente sensible. Otros métodos respirométricos propiamente dichos miden la producción de CO2 u otros gases como Metano, Anhídrido Sulfhídrico, etc. dentro de la botella.
En el Método Clásico, para la determinación de la DBO5, se calcula la diferencia entre el Oxígeno Disuelto en la muestra o en una dilución de la misma, entre el día 0 y el día 5. Este método tiene muchas limitaciones, siendo una de las principales la pequeña cantidad de oxígeno disponible en la muestra. Usualmente unos 10 mg/lt a nivel del mar, y menos de 7 mg/Lt a nivel de Bogotá (2540 m.s.n.m.). Si tenemos en cuenta que la muestra deberá terminar la prueba con al menos 1 mg/Lt, (algunas normas especifican terminar con al menos 2 mg/Lt) se observa que el oxígeno total disponible para la prueba será alrededor de 5 mg/Lt. En el supuesto caso de que se trabajase con Botellas de 0.5 Lt de capacidad, la cantidad absoluta de oxígeno disponible sería de tan solo 2.5 mg. En la mayoría de los Laboratorios usualmente se trabaja con Botellas de 300 ml., lo cual disminuye aun mas la cantidad de oxígeno disponible para la prueba. Esta pequeña cantidad a determinar hace que pequeños errores en la manipulación de la prueba produzcan grandes diferencias (errores) en el resultado.
En el método Respirométrico, trabajando con botellas de 1 lt de capacidad, llenas con medio litro de muestra o dilución de muestra, se cuenta hasta con 125 mg de Oxígeno, contenidos en el aire presente en la cámara superior de la botella. Y se puede contar aun con mayor cantidad de oxígeno en caso de trabajar con volúmenes inferiores de muestra. En este caso, el oxígeno disuelto, fuere cual fuere su contenido inicial en la muestra (exceptuando muestras altamente sobresaturadas) no tiene casi incidencia en el resultado. Por lo general esta por debajo de 2.5 mg frente a los 125 mg presentes en la cámara superior. Esto es un error máximo del 2 %.
ABSORCION DEL CO2
En el método llamado método manométrico, se mide el vacío creado por el consumo de oxígeno causado por la muestra.
Para que el método basado en la medición manométrica del vacío causado en la botella funcione adecuadamente es necesario absorber el CO2 formado de alguna manera. De lo contrario no habría cambio de presión en las botellas ya que el volúmen de CO2 producido podría ser igual o casi igual al volúmen de Oxígeno consumido.
La absorción del CO2 puede hacerse de varias maneras. 1. Adecuando el poder buffer de la solución en ensayo para absorber la totalidad del CO2, en forma de Bicarbonato disuelto en el líquido y 2. Absorbiendo el CO2 mediante algún hidróxido alcalino en un recipiente apropiado en contacto con la fase gaseosa de la botella.
En el presente artículo analizaremos ambas opciones aunque en principio consideramos que adecuar el poder buffer de la solución de ensayo es especialmente adecuado para la determinación de la Demanda Bioquímica de Oxígeno en 5 días en aguas y el método de absorber el CO2 en un recipiente con reactivos especiales insertos en la botella respirométrica es mas adecuado para la determinación de la respiración en muestras sólidas como suelos, deshechos orgánicos, lodos secos etc.
CAPACIDAD DE ABSORCION DE CO2 DEL SISTEMA DIFOSFATO-MONOFOSFATO
La cantidad de CO2 producida en el método respirométrico, al igual que la cantidad de oxígeno consumida, es relativamente mas grande que la producida en el método clásico. Esto requiere entonces de una adecuación del poder buffer de la solución de ensayo. Para adecuar el poder buffer de la solución de ensayo a las nuevas condiciones es necesario conocer la capacidad de absorción del CO2 del sistema Difosfato-Monofosfato dentro del rango de pH permisible o compatible con un crecimiento adecuado de los microorganismos presentes en la muestra en ensayo.
Como base teórica para la absorción del CO2 dentro del sistema tenemos la siguiente ecuación:
Na2HPO4 + CO2 + H2O -------------> NaHCO3 + NaH2PO4 (1)
De acuerdo con la anterior reacción 142 mg de Fosfato Disódico anhidro absorberían 44 mg de CO2
La anterior reacción es reversible y a medida que procede hacia la derecha se va reduciendo el pH del medio de tal manera que esta misma condición paraliza el desarrollo de la reacción en un punto intermedio de la transformación del Fosfato Disódico en Fosfato Monosódico. Creemos que no todo el Fosfato Disódico logra transformase en Fosfato Monosódico. Para saber que tanto CO2 logra capturar una solución de Fosfato Disódico se llevó a cabo el siguiente experimento:
Se preparó una solución de Fosfato Monosódico (NaH2PO4.H2O) de 2 gr/Lt. Se tituló con NaOH 0.1 N hasta viraje incipiente de la Fenolftaleina (Aproximadamente pH = 8.5-9.0). En este punto la solución se saturó con CO2 permitiendo así que se desarrolle la reacción (1) en la mayor extensión posible. Acto seguido se expulsó el CO2 libre mediante agitación y barrido con aire. Después se tituló en reversa con NaOH 0.1 N nuevamente hasta viraje incipiente de la fenolftaleina.
Se considera que la cantidad de CO2 fijado por el sistema es directamente proporcional a la cantidad de NaOH consumida en la segunda titulación.
Los datos del ensayo fueron los siguientes:
Titulación del Fosfato Monosódico
Alícuota de solución de Fosfato Monosódico = 25 ml
Cantidad de NaOH 0.1 N usado en la titulación inicial = 3.65 ml Esta
cantidad coincide casi exactamente con la cantidad teórica necesaria
para la transformación de todo el Fosfato Monosódico en Fosfato
Disódico según la ecuación siguiente:
NaH2PO4 + NaOH -------------------> Na2HPO4 + H2O
Fijación de CO2
Alícuota de solución de Fosfato Monosódico = 50 ml
Cantidad de NaOH 0.1 N usado en la titulación inicial = 7.2 ml
Saturación con CO2 y eliminación del Sobrante con Aire.
Titulación en reversa con NaOH 0.1 N = 4.5 ml
De acuerdo con la ecuación:
NaOH + CO2 --------> NaHCO3
40 gr de NaOH neutralizan 44 gr de CO2
Entonces 4.5 ml de NaOH 0.1 N neutralizarán 4.5 x 4 x 44/40 = 19.8 mg de CO2
Lo cual quiere decir que los 100 mg de Fosfato Monosódico (50 ml de solución de NaH2PO4.H2O de 2 gr/lt) utilizados, equivalentes a 87 mg de Fosfato Monosódico Anhidro y transformados en 102.9 mg de Fosfato Disódico anhidro tienen capacidad para absorber 19.8 mg de CO2 transformándolo en Bicarbonato de Sodio.
Al comparar el resultado teórico según la ecuación (1) con la cantidad resultante de este último ensayo se hace evidente que no todo el Fosfato disódico utilizado inicialmente logra transformarse en Fosfato Monosódico. En consecuencia, la cantidad de Fosfato Disódico que se debe utilizar como Buffer en la prueba respirométrica deberá ser de como mínimo de 102.9 mg por cada 19.8 mg de CO2
Si en una botella de 1 Lt de capacidad con medio litro de muestra y con disponibilidad de 125 mg de Oxígeno se espera una producción de 171.8 mg de CO2 se aconseja agregar 892.8 mg de Fosfato Disódico anhidro en calidad de buffer. (En la práctica agregar 1.000 gr) Nota: Esta cantidad de Fosfato en la práctica es cerca de 40 veces mas grande a la que se utiliza con el mátodo tradicional.
ABSORCION DEL CO2 EN RECIPIENTE APARTE INSERTO EN LA BOTELLA CON HIDROXIDO DE SODIO
Esta forma de absorber los gases tambien funciona adecuadamente y consiste en colocar en la cámara de aire encima del líquido, un recipiente perforado, en el cual se coloca hidroxido de sodio como material absorbente para el CO2. Este material absorbe rápidamente el CO2 producido. Se ha observado que la botella requiere algo de agitación para la adecuada y rápida absorción del CO2. De lo contrario la difusión del CO2 desde la parte inferior de la botella hacia el recipiente de absorción puede resultar demasiado lenta. Para la Absorción se debe tener en cuenta la siguiente ecuación:
2 NaOH + CO2 -----------> Na2CO3 + H2O
así quie 80 gr de NaOH absorberán 44 gr de CO2
Para una botella respirométrica de 1105 ml de capacidad, llena de CO2
puro a 20 °C, se requieren
1.105x0.8878x80/44 = 1.784 gr de NaOH y para una Botella normal con medio litro
de muestra, suponiendo que se agotara completamente el oxígeno de la
cámara y que se generan 125 x 44/32 = 171.8 mg de CO2 se requieren
171.8 x 80/44 = 312 mg de NaOH. En la práctica se recomienda colocar
1 gr de NaOH.
RESUMEN DEL METODO
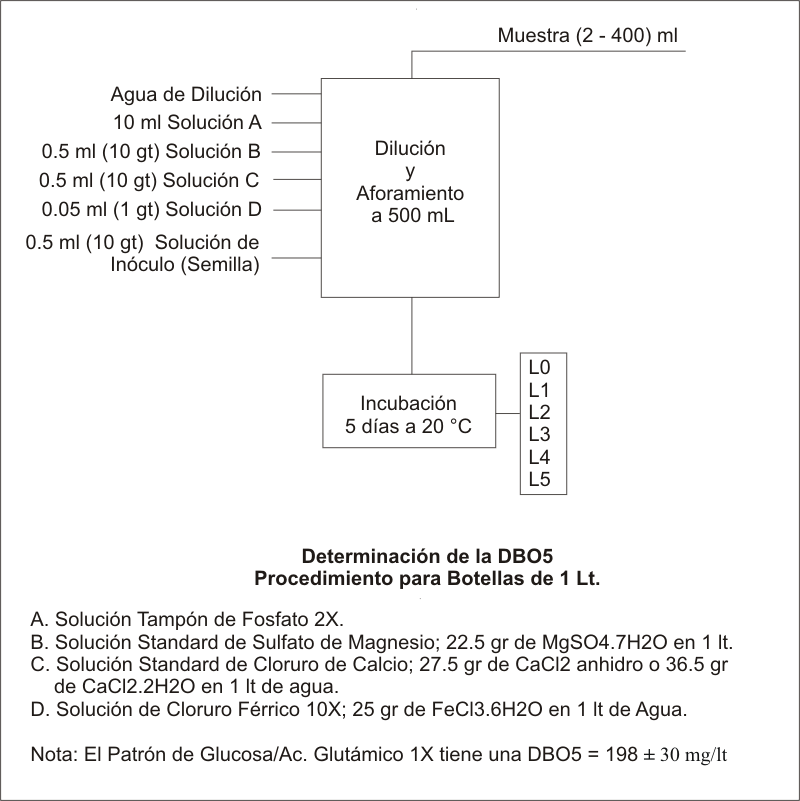
Para Botellas de 1 lt en las cuales Alícuota mas Agua de Dilución = 500 ml, el Oxígeno disponible en la Botella a la altura de Bogotá se calcula como sigue:
Densidad del aire a 20 °C = 0.8878 gr/lt. = 1.2931 x 273/293X560/760
Contenido de Oxígeno en el aire = 21 % volumétrico.
Peso del Aire disponible en la Botella = 0.44388 gr.
Contenido de Oxígeno disponible en la botella = aproximadamente igual
a 103 mg de O2 puro.
Para Botellas de 500 ml llenas hasta 250 ml, la disponibilidad de Oxígeno
será aproximadamente de 51.5 mg.
De acuerdo con lo anterior, se podrá entonces tomar la siguiente alícuota dependiendo de la DBO5 esperada:
1. Tomar una alícuota de muestra según la DBO5 esperada así:
|
DBO5 esperada |
Bot 1000 |
Bot 500 |
|
mg/lt |
Alícuota/Aforamiento ml/ml |
Alícuota/Aforamiento ml/ml |
|
32000 |
3/500 |
1.5/250 |
|
16000 |
6/500 |
3/250 |
|
8000 |
12/500 |
6/250 |
|
4000 |
25/500 |
12/250 |
|
2000 |
50/500 |
25/250 |
|
1000 |
100/500 |
50/250 |
|
500 |
200/500 |
100/250 |
|
250 |
400/500 |
200/250 |
|
100 |
400/800 |
200/400 |
|
50 |
800/800 |
400/400 |
2. Colocarla en la probeta de aforamiento y agregarle agua destilada saturada
de Oxígeno hasta un volúmen cercano a los 400 ml. El Oxígeno
presente en el agua de dilución deberá ser tenido en cuenta en
los cálculos finales ya que a grandes diluciones su valor alcanaza a
ser muy significativo.
3. Agregarle 10 ml de Solución A (Solución Tampón de Fosfato
Modificada 2X).
4. Agregarle 0.5 ml (10 gotas) de la Solución B (Sulfato de Magnesio).
5. Agregarle 0.5 ml (10 gotas) de la Solución C (Cloruro de Calcio).
6. Agregarle 0.05 ml (1 gota) de la Solución D (Cloruro Férrico
10X).
7. Agregarle 0.5 ml (10 gotas) de Solución Semilla Inóculo de
Agua Residual Urbana Fresca.
8. Completar a 500 ml con agua destilada y transferir a la botella respirométrica.
9. Cerrar la Botella y conectar el Transductor.
10. Colocar la botella en la cámara de Incubación, encima del
agitador Magnético o de Vaivén.
11. Iniciar la agitación, esperar que se homogenize la temperatura y
tomar la primera lectura (L0).
12. Tomar una lectura cada 24 horas durante los siguientes 5 días. Anotar
simultáneamente el valor de la temperatura de la cámara de incubación.
Simultáneamente con lo anterior, se debe realizar un blanco y ese valor deberá ser restado de los resultados de las muestras.
PREPARACION DE REACTIVOS
A. Solución Tampón de Fosfato Modificada (2X). Pesar 43.5 gr
de K2HPO4, 66.8 gr de Na2HPO4.7H2O y 3.4 gr de NH4Cl, disolver y aforar a 1
Lt.
B. Solución de sulfato de magnesio: Disolver 22,5 g de MgSO4.7H2O en agua destilada
y diluir a 1 L.
C. Solución de cloruro de calcio: Disolver 27,5 g de CaCl2 anhidro o 36.5 gr
de CaCl2.2H2O en agua destilada y diluir a 1Lt.
D. Solución de cloruro férrico (10X) : Disolver 2.5 g de FeCl3.6H2O en agua
destilada, diluir a 1L.
E. Solución Patrón de Glucosa Acido Glutámico 50X: Disolver
7.5 gr de Glucosa y 7.5 gr de Acido Glutámico en 800 ml de agua destilada
con ayuda de calor suave. Dejar enfriar y agforar a 1 lt con agua destilada.
Guardar en nevera en frasco de color ambar.
CALCULOS
Para los cálculos Utilizar el Software anexo. Cálculo de la DBO5
OTROS DATOS
Peso molecular Ponderado del Aire = 0.21 x 16 + 0.79 x 14 = 14.42
Densidad del Anhídrido Carbónico; D(aire=1) = 1.5291
DIAGRAMA
 |
BIBLIOGRAFIA
1. Jenkins, D., "The use of manometric methods in the study of sewage and trade
wastes," Waste Treatment, Pergamon Press, New York, 1960, pp99-125.
2. Montgomery, H.A.C., "The determination of biochemical oxygen demand by respirometric
methods,"Water Res., 1/1:632-640, 1967.
3. Clark, John W., "Continuous Recording BOD Determination," Water and Sewage
Works, 1960 p.107 .
4. Cadena, F. et al, "A Novel Approach to Simplified Respirometric Oxygen Demand
Determinations", Proceedings of the 43rd Industrial Waste Conference, Purdue
University, 1988.
5. Sawyer, C.N., (1958) "Effects of synthetic detergents on sewage treatment
processes" Sewage and Industrial Wastes, 30 pp. 757-775.
6. Grady Jr., C.P.Leslie, Environmental Systems Engineering, Clemson University,
Clemson, SC.
7. Gaudy Jr, Anthony F., University of Delaware, Newark, DE.
8. Graves, D.A., Lang, C.A., and Leavitt, M.E. "Respirometric Analysis of the
Biodegradation of Organic Contaminants in Soil and Water", Applied Biochemistry
and Biotechnology, Vol. 28/ 29 pp. 813 - 826 1991.
9. OECD (1981) OECD Guidelines for Testing of Chemicals, Section 3, Degradation
and Accumulation, Method 301C, Ready Biodegradability: Modified MITI Test (I),
Director of Information, OECD, Paris France.
10. Magliette, R., (Merck, Sharpe & Dohme) Personal communications