CONTROL DE VARIABLES HIDROPONICAS
Traducción y Adaptación
por: Felipe Calderón Sáenz
Adaptado de: Bruce Bugbee;
Crop Phisiology Laboratory, Utah State University
Dr. Calderón Laboratorios
Ltda., Mayo
18 de 2001
www.drcalderonlabs.com
Avda. 13 No. 87-81
Bogotá D.C., Colombia S.A.
acaldero@cable.net.co
INTRODUCCION
Al preparar esta conferencia tuve la oportunidad de leer gran cantidad de conferencias realizadas sobre los mismos temas en los distinos simposios y seminarios a nivel mundial. La cantidad de información útil me impresionó. La reunión anual y las memorias de la Hydroponic Society of America (HSA) así como de la Internationa Society of Soilless Culture (ISOSC) se han convertido en una fuente importante de información técnica sobre los cultivos hidroponicos. Es mucha la inforación que se ha producido sobre la utilización y manejo adecuado de las soluciones nutritivas. Muchos investigadores en los ultimos 5 años vienen resaltando la necesidad de recircular y de reutilizar soluciones nutrientes para reducir costos económicos y ambientales. El Dr. Pieter Schippers (Memorias 1991 de HSA) revisando lo relativo al manejo de soluciones nutritivas indicó claramente la necesidad de datos cuando dijo, "una de los aspectos más débiles de la hidroponía... es la carencia de información sobre el manejo de la solución nutritiva". Algunos autores recomiendan medir las concentraciones de los nutrientes individuales en la solución como herramienta clave para el control y manejo de los nutrientes. Según el Dr. Schippers, monitorear o medir los iones en la solución es innecesario. Las diferencias de velocidad en la tasa de absorción y agotamiento de algunos nutrientes llevan a menudo a agregar cantidades tóxicas de dichos nutrientes. Vigilar soluciones tanto de entrada como de salida es interesante, pero hay mas aspectos a considerar para lograr el manejo ideal.
MANEJO DE NUTRIENTES POR BALANCE DE MASA
Durante los últimos 15 a 20 años, nosotros hemos estudiado y recomendado manejar los nutrientes en los cultivos hidropónicpos según el principio del "Balance de Masa". Lo anterior significa que los nutrientes que pongamos en el riego van a parar al cultivo, al drenaje o se quedarán en el sustrato. Recomendamos agregar los nutrientes a la solución dependiendo de lo que queramos que la planta tome.
Las plantas absorben rápidamente su fuente diaria de algunos elementos mientras que otros se acumulan. Esto significa que las concentraciones de Nitrógeno, Fósforo y Potasio pueden ser bajas en el sustrato (0,1 mM o algo por el estilo ppm) ya que estos nutrientes deben estar en la planta, que es donde los deseamos. Mantener elevadas concentraciones de nutrientes "fáciles" en la solución puede dar lugar a una absorción excesiva que puede conducir a desequilibrios nutricionales.
Por ejemplo, el agua consumida de la solución a través de la evapotranspiración debe ser sustituida y es necesario poner de 15 a 45 ppm de Fósforo en la solución de riego. Cuando se riega una vez al dia, el fósforo es absorbido por la planta en algunas horas y la concentración de fósforo en la solución y el sustrato llega a cerca de cero. Esto no indica una deficiencia, por el contrario indica una planta sana con absorción rápida. Si el nivel de Fósforo se mantiene en 16 ppm en el medio, la concentración de fósforo en la planta podría aumentar hasta 1% de la masa seca, lo cual es 3 veces más que el nivel óptimo en la mayoría de las plantas. Este alto nivel de fósforo podría inducir deficiencia de hierro y de zinc (Chaney y Coulombe, 1982).
La alimentación de las plantas de esta manera es como la alimentación diaria de un perro doméstico. Algunos perros podría estar demasiado gordos si sus platones de alimentos estuvieran continuamente llenos.
REMOCION DIFERENCIAL DE NUTRIENTES
Los elementos esenciales se pueden agrupar en 3 categorías basadas en que tan rápidamente se absorben de la solución. Los elementos del grupo 1 son absorbidos por las raíces y son retirados de la solución nutritiva en unas pocas horas. Los elementos del grupo 2 tienen tasas intermedias del absorción y se retiran de la solución más rápido que la absorción del agua. Los elementos del grupo 3 se absorben pasivamente de la solución y se acumulan a menudo en el sustrato o en las soluciones residuales.
Table 1. Velocidades de Absorción comparativas para los elementos esenciales.
| Group 1. Absorción Activa, Remoción Rápida | N-NO3, N-NH4, P, K, Mn |
| Group 2. Absorción Intermedia | Mg, Fe, Zn, Cu, Mo, Cl |
| Group 3. Absorción Pasiva, Remoción lenta. | Ca, B, S |
Uno de los principales problemas con el manejo y control de las soluciones nutritivas es que la concentración de los elementos del grupo 1 (N, P, K, Manganeso) debe ser adecuada para prevenir una acumulación indeseable en el tejido de las plantas. Las concentraciones bajas son difíciles de vigilar y de controlar. La Tabla 2 muestra los errores típicos asociados al uso de la espectrofotometría para el análisis de las soluciones hidropónicas. El nitrógeno no se puede medir por absorción atómica. Como puede observarse la exactitud para los macronutrients es buena, pero los niveles de los elementos B, Cu, y Mo no se pueden medir exactamente por epectrofotometría en el rango de las concentraciones usuales en las soluciones nutritivas. Los datos de esta tabla son para una solución típica nueva. Los errores de medida para K, P, y Manganeso pueden ser 10 veces mayores cuando los niveles de la solución son más bajos.
Tabla 2. Errores de medición típicos asociados
con el uso de Espectrofotometía ICP para el análisis de las concentraciones
de nutrientes en las soluciones hidropónicas normales.
|
Elemento
|
Concentración en la Solución Nutritiva
|
Precisión ICP
|
Error Típico de Medición (%)
|
||||
|
mM
|
ppm
|
mM
|
ppm
|
||||
| K |
3.5
|
136
|
0.1
|
4
|
3
|
||
| Ca |
1.0
|
20
|
0.002
|
0.04
|
0.2
|
||
| S |
0.75
|
12
|
0.01
|
0.2
|
1
|
||
| P |
0.5
|
16
|
0.01
|
0.3
|
2
|
||
| Mg |
0.25
|
3
|
0.002
|
0.04
|
1
|
||
| MicroNutrientes |
(µM)
|
-
|
(µM)
|
-
|
(%)
|
||
| Fe |
5.0
|
0.3
|
0.15
|
-
|
3
|
||
| Mn |
3.0
|
0.3
|
0.3
|
-
|
10
|
||
| Zn |
1.0
|
0.06
|
0.15
|
-
|
15
|
||
| B |
1.0
|
0.01
|
3.0
|
-
|
300
|
||
| Cu |
0.1
|
0.006
|
0.2
|
-
|
200
|
||
| Mo |
0.03
|
0.003
|
1.0
|
-
|
3300
|
||
La cantidad total de nutrientes en la solución puede ser inferida fácilmente y exactamente midiendo la conductividad eléctrica de la solución. Sin embargo, debido al índice diferencial de absorción de nutrientes, las medidas de la conductividad miden sobre todo el Calcio, el Magnesio, el Sulfato, el Cloruro y el Sodio restantes en la solución. Los micronutrientes contribuyen menos de 0,1% a la conductividad eléctrica.
La ecuación para inferir esta relación es la siguiente:
C.E. mmhos/cm = 1/10 x (Sumatoria de Aniones en meq/lt) = 1/10 x (Sumatoria de Cationes en meq/lt)
La ecuación anterior lleva implicito que :
Sumatoria de Aniones en meq/lt = Sumatoria de Cationes en meq/lt
Esta relación es válida dentro de un cierto rango de pH cercano a la neutralidad. De lo contrario es necesario considerar las concentraciones de H y OH.
DESARROLLO DE UNA FORMULA APROPIADA PARA LA SOLUCION NUTRITIVA
El objetivo es desarrollar una fórmula de solución que suministre los nutrientes y el agua a la vez. Aunque las plantas han evolucionado para tolerar algunos desequilibrios de nutrientes grandes en la zona radicular, caundo se recirculan las soluciones en los sistemas hidropónicos o cuando no se promueve un drenaje suficiente, los desequilibrios en el medio radicular se vuelven acumulativos. Es pues importante entender los principios para la elaboración de la solución nutritiva, especialmente cuando la solución se recicla continuamente durante todo el ciclo de vida de un cultivo o cuando la solución se utiliza a drenaje cercano a cero.
Las recetas tradicionales de las soluciones nutritivas, tales como la solución de Hoagland, cuando se utilizan como solución de repuesto en sistemas cerrados es necesario diluirlas a cerca de 1/3 F para mantener la conductividad eléctrica constante. Cuando dichas soluciones se utilizan en sistemas abiertos en los cuales el suministro de agua es limitado, es necesario mantener concentraciones cercanas a 1F. La solución de Hoagland, sin embargo, fue desarrollada para tomates y no es siempre apropiada como solución para otros tipos de plantas.
Se deben considerar dos factores al desarrollar una solución nutritiva:
1. Composición de la Solución.
2. Concentración de la Solución.
COMPOSICION DE LA SOLUCION
Aplicando el principio del "Balance de Masas", la composición de
la solución o relación de nutrientes se debe calcular a parti de las concentraciones
deseadas de cada elemento en la planta. Un punto de partida para la composición
de la solución nutritiva es la relación de los elementos en las hojas de la
planta, las cuales se pueden hallar en un libro de consulta o mediante la interpretación
del análisis de la planta. Mencionamos cuatro libros clásicos que enumeran
las concentraciones óptimas de nutrientes en los tejidos de las plantas (y hay
probablemente otros libros):
1. Análisis de Plantas: Manual de Interpretación. 1986. D. Reuter y J. Robinson,
(eds). Ed. Inkata Press, Melbourne.
2. Manual de Análisis de Plantas. 1991. J. Benton Jones, B. Wolf, H. Mills.
Micro-Macro Publishing, Inc. Atenas.,
3. Análisis de Plantas. 1987. P. Martin-Prevel y J. Gagnard. Lavoisier Publishing
Inc. Nueva York.
4. Criterios de diagnóstico para Plantas y Suelos. 1966. Chapman, Homer. Univ.
de la California, Riverside, CA.
Cada uno de estos libros viene organizado diferentemente y cada uno tiene sus fuerzas y sus debilidades. Recomiendo recoger la información de todos para un cultivo determinado y comparar los valores dados para el rango óptimo de concentraciones de nutrientes para sacar la mejor conclusión posible.
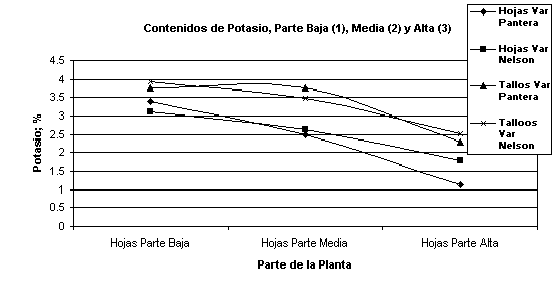
El análisis foliar sirve para conocer la concentración de cada nutriente en las hojas porque las hojas realizan la mayoría de la fotosíntesis y suelen tener los niveles más altos de enzimas y nutrientes en las plantas. Las concentraciones de nutrientes promedias en las plantas enteras son generalmente menores que las concentraciones en las hojas, así que una solución nutritiva basada solamente en la concentración del tejido de la hoja será sobredosificada para los tallos, las semillas y los frutos. Esta realidad es diferente para cada clase de plantas, siendo las herbáceas como el clavel mas acumuladoras de Potasio en los tallos que las leñosas como las rosas. Se han realizado muchas medidas de concentraciones de nutrientes en diversas partes de las plantas de Rosas, Clavel, Pompón, Sanapdragon, Alstroemeria, etc. La Tabla 3 muestra un ejemplo de estas concentraciones.
Tabla 3. Concentración de Nutrientes en diversas partes de las Plantas
de Clavel, Var Nelson.
| IDENTIFICACION |
Tallos Parte Baja
|
Tallos Parte Media
|
Tallos Parte Alta
|
Hojas Parte Baja
|
Hojas Parte Media
|
Hojas Parte Alta
|
| N_TOTAL % |
1.44
|
1.89
|
2.65
|
3.15
|
3.63
|
4.49
|
| FOSFORO % |
0.56
|
0.48
|
0.32
|
0.27
|
0.29
|
0.2
|
| POTASIO % |
3.77
|
3.76
|
2.3
|
3.4
|
2.49
|
1.14
|
| CALCIO % |
0.39
|
0.52
|
0.82
|
2.21
|
2.45
|
3.15
|
| MAGNESIO % |
0.14
|
0.19
|
0.57
|
0.72
|
0.86
|
0.85
|
| AZUFRE % |
0.22
|
0.28
|
0.28
|
0.4
|
0.37
|
0.33
|
| CLORUROS % |
--
|
--
|
--
|
1.32
|
1.15
|
0.74
|
| HIERRO ppm |
41
|
38
|
59
|
91
|
77
|
63
|
| MANGANESO ppm |
22
|
30
|
28
|
194
|
195
|
199
|
| COBRE ppm |
9
|
10
|
9
|
5
|
4
|
3
|
| ZINC ppm |
37
|
37
|
42
|
56
|
55
|
58
|
| BORO ppm |
16
|
18
|
9
|
53
|
49
|
90
|
| SODIO ppm |
1450
|
1456
|
1119
|
4862
|
3465
|
2098
|
Las plantas jóvenes desarrollan fácilmente deficiencias de nutrientes pero rara vez desarrollan toxicidades de nutrientes así que se recomienda utilizar una solución inicial relativamente concentrada como "starter".
Una solución con concentraciones adecuadas de nutrientes para el crecimiento vegetativo inicial foliar generalmente es muy concentrada cuando las plantas están desarrollando tallos y hojas así que recomendamos alteramos la composición de la solución para ajustarla a la etapa del crecimiento de la planta para prevenir la acumulación de nutriente en la solución de drenaje o el sustrato.
Para el caso del cultivo del clavel, el ciclo vital se puede dividir en 3 etapas:
1. Crecimiento vegetativo temprano, semanas 0-10, se compone sobre todo de
tejido de hojas. Se recomienda la utilización de una Solución Starter
mas rica en Nitrógeno.
2. Crecimiento vegetativo tardío, semanas 10 a 20, durante el cual el
crecimiento se compone de cantidades aproximadamente iguales de tejido de tallos
y hojas. Se recomienda la utilización de una solución acorde a esta etapa
de crecimiento.
3. Crecimiento reproductivo, semanas 20 - 30, durante el cual el crecimiento
de la hoja es mínimo y los nutrientes se movilizan hacia los organos reproductivos.
Se recomienda la utilización de una solución para llenado de estructuras
reproductivas.
El crecimiento primario de las raices ocurre sobre todo durante el crecimiento vegetativo temprano y es mucho menos significativo durante el Crecimiento vegetativo tardío. El enraizamiento disminuye e incluso para durante la etapa reproductiva
La tabla 4 muestra la solución nutritiva que recomendamos para las diferentes etapas en el cultivo del Clavel. En la práctica se utiliza una solución de compromiso para las diferentes etapas de vida del cultivo, ya que en una misma finca coexisten plantas de diferentes edades, a veces dentro de una misma válvula de riego.
Tabla 4
|
Crecimiento Inicial (Starter)
Semanas 0-10 |
Crecimiento Vegetativo
Semanas 10-20 |
Crecimiento Reproductivo
Semanas 20-30 |
|
|
ppm
|
|||
| N |
220
|
180
|
140
|
| P |
45
|
30
|
25
|
| K |
160
|
180
|
220
|
| Ca |
170
|
120
|
60-80
|
| Mg |
45
|
30
|
15-20
|
| S |
32
|
20
|
15-25
|
| Fe |
5
|
2
|
1
|
| Mn |
0.5
|
0
|
0
|
| Cu |
0.5
|
0.2
|
0.1
|
| Zn |
1.0
|
0.2
|
0.1
|
| B |
2.0
|
0.6
|
0.4
|
| Mo |
0.2
|
0.1
|
0.05
|
Con respecto a estas soluciones veamos ciertas particularidades:
Nitrógeno
Usualmente entre un 75 y un 90 % del Nitrógeno se debe suministrar como Nitrógeno Nítrico. Cuando se necesita controlar el pH y se recurre al uso de Acido Nítrico este debe ser descontado de la formula global. El uso de fuentes amoniacales como el Nitrato de Amonio y el Sulfato de Amonio causan descenso del pH así que estas podremos utilizar para buscar este efecto.
Fósforo
Usualmente suministrado como acido Fosfórico, deberá ir dividido en dos tanques en los sitemas duales de inyección.
Potasio
El Potasio deberá ir mas concentrado al final del ciclo cuando las plantas tienen mayor necesidad para la translocación del elemento a las partes altas de la planta.

Calcio
El Calcio tende a acumularse en el sustrato con el paso del tiempo, máxime cuando se utilizan enmiendas sólidas de Carbonato de Calcio, Hidróxido de Calcio y Yeso.
Magnesio
Elemento de absorción lenta también tiende a acumularse en el sustrato con el paso del tiempo.
Azufre
Elemento, al igual que el magnesio, de absorción relativamente perezosa. Las plantas de clavel casi nunca acumulan exceso de Azufre aunque este esté presente en la solución o en el sustrato.
Ejemplos:
Análisis por Balance de Masa para dosificación de Potasio en base a Relaciónde Masa Seca Formada /Agua Evapotranspirada.
Caso1
Asuma una transpiración de agua a masa seca formada de 300:1 y una concentración
deseada en el tejido seco de 4 % (40 gr/kg). Por cada kilogramo de crecimiento
de la planta, pasan 300 lts de agua o sea que la solución deberá
tener 40 gr/0.300 mt3 = 133 ppm
Caso 2
Condiciones de baja humedad. Si la tasa de transpiración a crecimiento
es de 400:1, la solución deberá ser mas diluida o sea 40/0.400
mt3= 100 ppm.
Caso 3
Si la planta esta en la fase reproductiva, su requerimiento de Potasio puede
ser de solamente el 2 % en el tejido. Si la relación de materia seca
formada a agua evapotranspirada es de 1:300 la solución debería
ser de 20/0.300 = 66 ppm.
CONCENTRACION DE LA SOLUCION
La concentración de iones en la solución nutritiva esta determinada por la relación de transformación de la transpiración en crecimiento. La transpiración determina el índice del consumo de agua; el crecimiento determina el índice del consumo de nutrientes. Un buen estimativo de la transpiración al crecimiento para las plantas hydroponicas es 300 a 400 kilogramos (litros) de agua transpirados por cada kilogramo de masa seca formada. En algunas imvestigaciones en invernadero en la sabana de Bogotá se han obtenido indices de 200 lts de agua (Calderón, 1985-1987). La relación de transformación exacta depende de la humedad del aire. La transpiración disminuye con de los aumentos de la humedad pero no aumenta el crecimiento. El aumento del CO2 cierra un poco los estomas y aumenta la fotosíntesis así que la relación de transpiración a crecimiento puede bajar hasta 200 a 1.
Eln conocimiento de estas relaciones de transformación es útil en la determinación de la concentración optima de la solución nutritiva. Por ejemplo, solución de Hoagland 1/2 Full puede estar bien O.K. para plantas cultivadas a concentración normal de CO2 en el medio ambiente, pero puede ser necesaria una mayor concentración para plantas cultivadas a mayor concentración de CO2. Otros factores como la temperatura y el viento también afectan esta relación.
La concentración total de iones se puede controlar mediante mediciones de la conductividad eléctrica de la solución de drenaje. Si la conductividad aumenta, la solución nutritiva deberá hacerse más diluída, pero la composición se debe mantener igual. La conductividad eléctrica no cambia tan rápidamente así que generalmente es suficiente vigilarla solamente algunas veces cada semana. En nuestro laboratorio hemos utilizado con éxito este procedimiento aun en los estudios a largo plazo (dos años) sin el desecho de ninguna solución. Este procedimiento puede eliminar la necesidad de vigilar concentraciones de la solución nutritiva de entrada.
RECUPERACION DE NUTRIENTES EN EL TEJIDO DE LAS PLANTAS
Según lo mencionado anteriormente, el manejo de las soluciones nutritivas mediante el balance de masa asume que todos los nutrientes están en la solución, en el sustrato o en la planta. Sin embargo son pocos los estudios detallados del equilibrio total que se han realizado para probar esta hipótesis. Sin embargo, los estudios en nuestro laboratorio y los estudios del Dr. Wade Berry en UCLA indican claramente que la recuperación de varios elementos es menor de el 100%, mientras que la recuperación de algunos microelementos es mucho mayor de el 100%. la Tabla 5 muestra las recuperaciones medias de elementos de la solución en seis replicaciones en estudios de hasta 6 meses de duración. Estas recuperaciones son típicas para los sistemas hidropónicos. Debido a que la recuperación de macronutrientes es del 50 al 85%, se deben agregar macronutrientes adicionales a solución Nutritiva. Las cantidades reducidas de algunos microelemenrtos pueden ser utilizadas cuando la contaminación es anticipable.
Tabla 5. Recuperaciones medias de los elementos esenciales en tejido de planta
| Elemento | % Recuperación |
|---|---|
| N | 70 |
| P | 75 |
| K |
85
|
| Ca | 50 |
| Mg | 70 |
| S | 50 |
| Fe | 50 |
| Mn | 280 |
| B | 60 |
| Zn | 400 |
| Cu | 600 |
| Mo | 1000 |
La recuperación de todos los macronutrientes, del hierro y del boro fue del 50 al 85% de las cantidades agregadas a la solución nutritiva (menos los que permaneción en la solución al final del ensayo). La recuperación del manganeso, del Zn, del Cu, y del Mo fue mayor de el 100% debido a la contaminación de la solución hidropónica con elementos de los plásticos, de las bombas, del mecanismo impulsor y por sobre todeo del sustrato. Muchos diversos tipos de plásticos utilizados para construir los sistemas hidropónicos utilizan Zinc, Cobre y Manganeso como catalizadores durante su fabricación. Estas elementos aparecen despues y recuperaciones son típicas en sistemas hidroponicos.
MONITOREO Y CONTROL DEL pH
Que tan inportante es el control del pH..?
La mayoría de la gente asume que control del pH es esencial, pero hay malentendidos considerables sobre el efecto del pH en el crecimiento vegetal. Las plantas crecen igualmente bien entre pH 4 y 7, siempre que los nutrientes no lleguen a ser limitantes. Esto es porque los efectos directos del pH en el crecimiento de la raíz son pequeños. El problema es disponibilidad de nutrientes reducida en el pH alto y bajo. El pH recomendado para los culltivos hidroponicos está entre 5,5 y 5,8 porque la disponibilidad total de los nutrientes se optimiza en un pH levemente ácido. Las disponibilidades del Mn, del Cu, del Zn y especialmente del Fe se reducen en un pH más alto, y hay una disminución pequeña de la disponibilidad de P, K, Ca y Mg. Un pH reducido significa menor disponibilidad, pero no deficiencia necesariamente.
Algunos sistemas hidropónicos, especialmente aquellos que no llevam sustrato sólido ni enmiendas pueden resultar dificiles para mantener el pH entre 4 y 7 sin control automático del pH. El Fósforo como H2PO4 o HPO4 en la solución amortigua el pH, pero si el fósforo se mantiene en niveles que son adecuados para estabilizar el pH (1 a 10 mM), llega a ser tóxico para las plantas. Las plantas absorben activamente el Fósforo de la solución así que una solución que llegue, con cerca de 2 ppm de P tiene mucho menos capacidad tampón que la solución Nueva.
QUE TAN IMPORTANTE ES MANTENER EL pH en 5.8 ?
Experimentos realizados con plantas en ausencia de sustrato han demostrado que prácticamente no hay ddiferencia de crecimientro entre pH 4 y pH 5.8. Incluso en nuestro laboratorio hemos cultivado plantas permanentemente a un pH de 4 duranto todo el ciclo de cultivo. Lo que sucede es que cuando hay sustratos de por medio, las disponibilidades de nutrientes pueden verse afectadas por las interacciones entre la solución y los sutratos. En este sentido es importante tener en cuenta los elementos que sueltan los sustratos como, Manganeso en el caso de la cascarilla de arroz, Boro en el caso de algunas escorias, Cloruros y Sodio en la cáscara de coco, acidez en las espumas fenólicas etc., y tomar las debidas consideraciones en cada caso.
No obstante aunque aunque hay un amplio rango de pH acceptable, sigue siendo mejor mantener el pH cerca de 5,8 para optimizar la disponibilidad de nutrientes. Niveles del pH debajo de 4 pueden comenzar a reducir el crecimiento de la raíz. En un estudio nuestro en el que el control del pH falló enseguida el pH se fué a 2,5 por 48 horas. Las raíces se pusieron de color marrón y muchas murieron, pero despues de corregir la condición las nuevas raíces crecieron rápidamente y las plantas tuvieron una recuperación completa.
FRECUENCIA DE ADICION DE SOLUCION NUTRITIVA
Independientemente del factor agua, el cual ya ha sido tratado en otra parte, la frecuencia de adición de soluciones nutritivas desde el punto de vista de los nutrientes merece especial consideración. Debido a que los nutrientes con absorción activa se agotan en horas, parece que fuera necesaria la adición automática para evitar el agotamiento. Sin embargo frecuentes adiciones no han probado ser necesarias. Los nutrientes que son rápidamente absorbidos por las plantas de la solución son móviles en las plantas. Esto significa que las plantas pueden almacenarlos en las raices, tallos, hojas y removilizarlos cuando sean necesario. Nosotros hemos realizado estudios con Nitrógeno, en los cuales pusimos la solución cada dos dias y dejamos que la solución del sustrato se agotara hasta cerca de cero, lo cual ocurrió cerca de 12 horas. El crecimiento fue idéntico a los testigos los cuales fueron mantenidos a constante amplio suministro de N.
Otrso estudios realizados pro el Dr. Bugbee demuestran que cuando se grega un exceso de N a una solución starter, pero el N se suspende posteriormente, las plantas absorben rápidamente todo N hasta que el nivel de la solución desciende a 0.3 ppm en un período de 16 días. Las plantas tuvieron así N-NO3 en sus hojas pero el N total asimilado en base seca fue ligeramente inferior al de los testigos (con suministro amplio y constante de N). Los resultados de este estudio sugieren que los nutrientes removilizados no son tan utiles como los nutrientes recientemente absorbidos.
En la practica, la frecuencia de riego, esta determinada por la relación entre volumen retenido en un riego y la tasa de absorción y crecimiento de la plata. Paqueños volúmenes radiculares para grandes plantas requeriran frecuentes riegos de agua y nutrientes.
Cuando la solución nutritiva se agrega a diario en forma abundante y concentrada, pueden acumularse excesos de nutrientes en las plantas, los cuales conducen a desórdenes como el rajado de tallos, que ya hemos analizado en otra parte. Es pues necesario llegar a un compromiso entre la cantidad, la frecuencia y la concentración de la solución nutritiva y una de las mejores formas de hacerlo es, como nos propone el Dr. B. Bugbee, teniendo en cuenta el balance de Masa.
FIN